Al combinarse los átomos de Silicio para formar un sólido, lo hacen formando una estructura ordenada llamada cristal. Esto se debe a los "Enlaces Covalentes", que son las uniones entre átomos que se hacen compartiendo electrones adyacentes de tal forma que se crea un equilibrio de fuerzas que mantiene unidos los átomos de Silicio.
Vamos a representar un cristal de silicio de la siguiente forma:
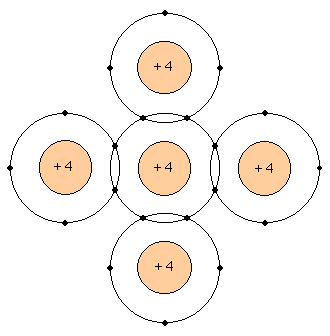
La fuerza del enlace covalente es tan grande porque son 8 los electrones que quedan ( aunque sean compartidos ) con cada átomo, gracias a esta característica los enlaces covalentes son de una gran solidez.
Los 8 electrones de valencia se llaman electrones ligados por estar fuertemente unidos en los átomos.
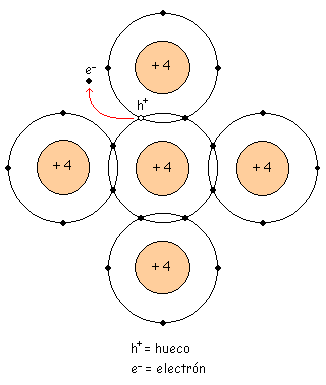
 | Enlace covalente roto: Es cuando tenemos un hueco, esto es una generación de pares electrón libre-hueco. |
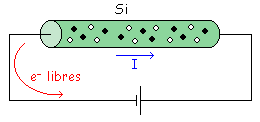
Según un convenio ampliamente aceptado tomaremos la dirección de la corriente como contraria a la dirección de los electrones libres.





No response to “Cristales de silicio”
Publicar un comentario